El gobierno de Inglaterra y la farmacéutica estadounidense Pfizer en alianza con BioNtech anunciaron un gran avance mundial al aprobar el uso de la vacuna ARNm COVID-19 (BNT162b2) para el combate del COVID-19, y establecer los primeros avances para una vacunación masiva global.
De acuerdo a la información de la farmacéutica, el proyecto es dotar de 40 millones de vacunas entre 2020 y 2021 al Reino Unido para garantizar un acceso equitativo al medicamento. La empresa está en espera de la aprobación del uso de emergencia de esta vacuna de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) y en diversos organismos sanitarios de Latinoamérica.
Ante la polémica de la red de ultra-frío que requiere esta vacuna, la farmacéutica garantiza el traslado y preservación por 10 días del medicamento es una realidad y se comprometió a establecer esquemas de mayor tiempo de preservación de los lotes del producto.
La farmacéutica subraya que esta vacuna requiere doble aplicación por persona, teniendo un tiempo promedio de 21 días entre cada aplicación.
En México y Latinoamérica se mantienen los trámites de aprobación de esta vacuna, en palabras de Hugo López-Gatell, la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) analiza la aprobación de la misma, aunque, dicho trámite parece que ya fue solventado con la firma del contrato para adquisición de este medicamento.
Al momento se tiene planeado el adquirir entre 34.4 millones de dosis de BioNtech/Pfizer dependiendo las necesidades del país y tener dichos lotes para el primer trimestre del 2021, indica la Secretaría de Salud federal.
El secretario de Salud, Jorge Alcocer, detalló que se tiene previsto que al cierre del 2020 se tenga un primer lote de 250 mil vacunas que serán aplicadas al personal médico que atiende a pacientes COVID-19.
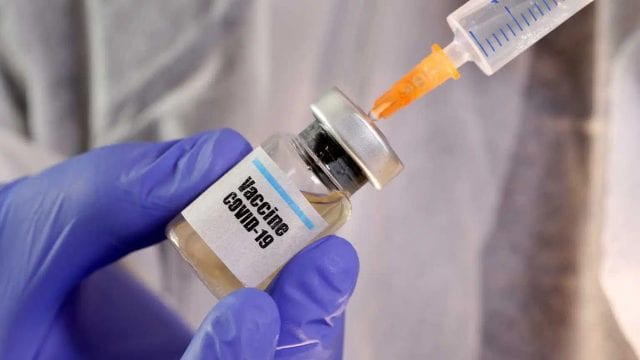
El funcionario federal ratificó que la vacuna se aplicará bajo un régimen similar a otras jornadas de vacunación que se regirá con la Política Nacional de Vacunación contra el virus SARS-Cov2, programa federal que se presentará de forma oficial en unos días. Para la vacunación se tiene contemplado un presupuesto 20,000 millones de pesos.
Por su parte, la oficina de Pfizer en México informó que no hablará del tema, pues la comunicación institucional depende de la matriz en Estados Unidos, sin embargo, ratificó que se tiene en pendiente la aprobación de su vacuna en la FDA como en organismos latinoamericanas para comenzar la dotación de vacunas.
Pese a que circula información en Internet y redes sociales, la farmacéutica no acepta tener un listado de primeras naciones a ser susceptibles de recibir vacunas. Sin embargo, en Estados Unidos circula se detalla que 15 de diciembre llegarán las primeras ampolletas.
Cabe recordar que Alejandro Cané, jefe de Asuntos Científicos y Médicos para América del Norte de la División de Vacunas de la farmacéutica Pfizer, declaró a periódico AM de Querétaro que la expectativa de diversos laboratorios, es contar con millones de vacunas
para el control del coronavirus para una factible segunda oleada de la pandemia al 2021.
Relató que las pandemias son eventos inesperados que atacan a la humanidad en ciclos, en promedio cada 100 años, siendo su mayor antecedente la gripe española de 1918. “Nadie estamos esperando una aparición tan pronta y fuerte de una enfermedad como es la COVID-19. Su fuerza es inédita, pero la humanidad ha demostrado una gran madurez al enfrentarlo y no sólo la medicina actúa en su contra, se tiene la cultura de la higiene, la sana distancia y el orden ciudadano que evita no se desborde de una forma épica”.
Añadió que “debemos seguir trabajando sin egoísmos, en sinergia, empresas, gobiernos y como sociedad estar más organizados como preparados para tener mejores políticas de salud para bienestar de todos los seres humanos”.
Recordó que un trabajo de gabinete para establecer una vacuna comienza con una selección de unas 10 mil moléculas con factibilidad de convertirse en la sustancia central de una medicina, tras ello, se desglosan las investigaciones, analizando no existan repercusiones posteriores al utilizarla y, al final sólo dos o tres moléculas son susceptibles de convertirse en medicamento, por ello, la tardanza en aprobar una medicina.
La propuesta, estudio, investigación, desarrollo, pruebas y aprobación de una molécula medicinal conlleva un tiempo unos 5 a 7 años, para que las naciones la incluyan en sus marcos de medicinas; en este caso se acortó el tiempo a sólo unos 12 meses.


